Öz
Giriş ve Amaç: Yoğun bakımda COVID-19 ile takip edilen ARDS hastalarında kullanılan iki farklı deksametazon tedavi protokolünün klinik ve laboratuvar sonuçlarını retrospektif olarak karşılaştırmak.
Yöntem ve Gereçler: Pandemi Yoğun Bakım Üniteleri’nde deksametazon tedavisi başlanmış hastalar iki gruba ayrıldı. Grup 1: 6 mg/gün deksametazon tedavisi alanlar (n=41), Grup 2: 0-5 gün 20 mg/gün ve 6-10 gün 10 mg/gün deksametazon tedavisi alanlar (n=39). 0. günden 10. güne gruplar arası klinik sonuçlar ve laboratuvar değerlerin değişimleri karşılaştırıldı.
Bulgular: 20 mg deksametazon verilen hastalarda 0. gün APACHE II skorları anlamlı düzeyde yüksek tespit edildi (p: 0,039). Hastaların yoğun bakımdaki on günlük deksametazon tedavisi sonrasında 0. ve 10. gün parametre değişimleri incelendiğinde; 20 mg grubunda prokalsitonin ve D-Dimer değerlerinin istatistiksel olarak anlamlı bir artış gösterdiği belirlendi (sırasıyla p: 0.038 ve p: 0.025). Son olarak deksametazon tedavisinin mortalite üzerindeki etkisi incelendi ve gruplar arasında fark saptanmadı.
Tartışma ve Sonuç: COVID-19 yoğun bakım ünitelerindeki ARDS hastalarında, deksametazon tedavisiyle ilgili literatürde mortalite karşılaştırmaları yapılmıştır. Bizlerse çalışmamızda farklı olarak mortaliteyle birlikte laboratuvar parametreleri açısından karşılaştırma yaptık. Sonuç olarak; deksametazon tedavisinin klinik ve laboratuvar parametreleri iyileştirdiği fakat fayda/zarar oranı ve yan etkileri açısından bakıldığında; viral solunum yolu enfeksiyonlarında oksijen tedavisi ihtiyacı olan olgularda 6 mg dozunun, hiperinflamasyonun ön planda olduğu şiddetli olgularda ise 20 mg dozunun güvenle kullanılabileceğini düşünmekteyiz.
Anahtar Kelimeler: anesteziyoloji ve reanimasyon, yoğun bakım, COVID, ARDS, deksametazon
Giriş
Corona Virus Disease-19 (COVID-19)’a neden olan Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) hızla yayılarak dünya sağlığını tehdit etmiş olan bir virüstür (1). Vakalar asemptomatik klinik durumdan şiddetli solunum yetmezliğine uzanan bir yelpazede değişkenlik göstermiştir (2). COVID-19’un neden olduğu solunum yetmezliği patogenezinde 2 ana sürecin etkili olduğu düşünülmektedir. Bunlardan ilki, klinik seyrin başlarında hastalığın esas olarak virüs replikasyonundan kaynaklanmasıdır. Diğeri ise ilerleyen dönemlerde disregüle immün yanıt nedeniyle doku ve organ hasarının ortaya çıkmasıdır (3).
Organ hasarında prognozu belirleyen Akut Solunum Sıkıntısı Sendromu yani Akut Respiratuar Distres Sendromu (ARDS); multifaktöriyel etyolojiye sahip, akut gelişimli, alveokapiller geçirgenlikte artmaya bağlı meydana gelen, bilateral pulmoner ödem ve ağır hipoksemi tablosudur. Bu tabloda solunum yetmezliğine sebep olan ana faktör disregüle sistemik ve pulmoner inflamasyondur (4).
Sistemik hiperinflamasyon sonucunda ortaya çıkan makrofaj aktivasyon sendromu (MAS); yakın takip ve erken tedavi gerektiren bir tablodur. Çünkü inflamatuar sitokinlerin kontrolsüz üretimi, yeni sitokinlerin salınımını tetikleyerek ARDS ve çoklu organ hasarına neden olmaktadır (5). Artmış viral replikasyon ve sitokin cevabın sonucunda hücrelerde apopitoz indüklenir. Endotel ve epitel hücrelerinin apopitozu, pulmoner mikrovasküler ve alveolar epitel hücrelerinde hasara neden olur ve vasküler sızıntı meydana gelir. Bu yüzden COVID-19 hastalarındaki ARDS patogenezinde inflamatuar mediatörler önemli rol oynamaktadır (6).
COVID-19 hastalarının tanı ve izlemlerinde laboratuvar testlerinin rolü oldukça önemlidir. Tanı konulmasına ek olarak, hastalığın şiddetini belirlemek ve mortalite riskini öngörmek açısından klinik pratikte sık kullanılmaktadır. Yoğun bakım skorlama sistemlerinin yanında (APACHE, SOFA vb) daha basit, kolay elde edilebilir ve ucuzdurlar. Sistemik hiperinflamasyon göstergesi olarak hematolojik parametreler, prokalsitonin (PCT), C-Reaktif Protein (CRP), Ferritin ve D-Dimer değerleri COVID-19 şiddeti ile ilişkili bulunan prognostik belirteçlerdendir (1,7).
COVID-19 hastalarında ki ARDS tedavisinde, kortikosteroidlerin antiviraller ile birlikte kullanımının etkinliği klinik çalışmalarda incelenmekle birlikte şiddetli hastalığı olanlarda faydalı olduğuna dair çalışmalar mevcuttur (8,9). Bu çalışmalarda farklı dozda ve türde kortikosteroid kullanılmıştır. Halen en uygun ilaç ve dozun hangisi olacağı ve kortikosteroid tedavisine ne zaman başlanacağı belirsiz görülmektedir (10).
COVID-19 ve kortikosteroidler ile ilgili literatür incelemesinde; çalışmaların çoğunlukla mortalite değerlendirmesi ile ilgili olduğunu; farklı iki deksametazon dozunun hiperinflamasyonun kontrol altına alınması açısından klinik ve laboratuvar sonuçlarının birbirleri ile henüz karşılaştırılmamış olduğunu gördük. Bu nedenle 6 mg ve 20 mg deksametazon tedavi protokollerinin sistemik inflamasyon parametrelerinde fark oluşturduğu hipotezinden yola çıkarak; yoğun bakımda takip edilen COVID-19 nedenli ARDS hastalarında, iki farklı deksametazon dozunun hiperinflamasyon üzerine klinik sonuçlar ve labarotuvar parametrelerine etkisini; sistemik inflamasyon penceresinden bakarak karşılaştırmayı amaçladık.
Gereç ve Yöntem
Çalışmamız retrospektif gözlemsel kohort çalışması olarak yapılmıştır. Çalışmaya 01.08.2020 - 01.03.2021 tarihleri arasında Anesteziyoloji ve Reanimasyon Pandemi Yoğun Bakım Üniteleri’nde COVID-19 enfeksiyonu tanısı Polimeraz Zincir Reaksiyonu (PCR) testi ve/veya toraks bilgisayarlı tomografisi (BT) ile konmuş ve kortikosteroid tedavisi başlanmış hastalar dahil edilmiştir. Deksametazon başlama günü 0. gün olarak tanımlanmıştır. Grup 1‘de 6 mg/gün deksametazon tedavisi alan, Grup 2’de ise 0-5 gün 20 mg/gün ve 6-10 gün 10 mg/gün deksametazon tedavisi alan hastalar yer almıştır.
Hasta verileri hastane otomasyon sistemi ve hasta dosyalarından retrospektif olarak sağlanmıştır. Birincil sonlanım noktası 28 günlük mortalite; ikincil sonlanım noktası inflamasyon değişimi yani sıfır ile onuncu günlerdeki laboratuvar ve klinik sonuçlarının karşılaştırılmasıdır.
Pandemi yoğun bakım işleyişinde rutin olarak hastaların demografik bilgileri ve geliş solunum durumları kaydedilmekte, toraks BT görüntülemeleri yapılmaktadır. Hastaların yoğun bakıma kabulünde ki solunum destek tedavi ihtiyacı; yok, nazal oksijen kanülü, rezervuarlı oksijen yüz maskesi, yüksek akımlı nazal oksijen (HFNO) kanülü, noninvaziv ventilasyon (NIV) ve invaziv mekanik ventilasyon (IMV) şeklinde kayıt edilmiştir.
Her hastaya tedavi başlama anında ki güncel Türkiye Cumhuriyeti Sağlık Bakanlığı COVID-19 Tedavi Rehberi’ne uygun şekilde tedavi başlanmıştır. Hastalara uygulanan kortikosteroid (deksametazon); takip eden yoğun bakım hekiminin klinik kararı ile literatüre uygun olarak; 2 farklı dozda (6 mg veya 20 mg şeklinde) uygulanmıştır. Takiplerinde günlük olarak hemogram (WBC, PLT, NEU, LYM, RDW-CV, MPV, PDW), biyokimya (PCT, Ferritin, D-Dimer, CRP, Albümin) ve ventilasyon (P-Plato, P-Peak, Kompliyans) parametreleri ile klinik değerlendirmeleri (Entübasyon günü, Yoğun Bakım Kalış Günü, Hastane Kalış Günü, Yoğun Bakım Mortalite Günü, 28 Günlük Yoğun Bakım Mortalitesi, Hastane Mortalitesi) kayıt edilmiştir. Entübasyon günü olarak hastaların yoğun bakıma yattıkları günden itibaren invaziv mekanik ventilatör desteği ihtiyacı olup; entübe edildiği gün kabul edilmiştir. Yoğun bakım kalış günü; hastaların yoğun bakımda tedavi aldığı toplam gün sayısı olarak kaydedilmiştir. Hastane kalış günü ise hastaların pandemi yoğun bakım ve pandemi servisindeki toplam kalış gününü ifade etmektedir. Yoğun bakım mortalite günü hastaların yoğun bakımda öldüğü gün sayısı olarak kaydedilmiştir. 28 günlük yoğun bakım mortalitesi 28 gün içinde ölen hastaları; hastane mortalitesi ise hastane yatışı içinde ölen hastaları kapsamaktadır.
COVID-19 yoğun bakımda uzman hekimlerin vermekte olduğu 2 farklı deksametazon dozunun yukarıda bahsedilen parametrelere etkisi retrospektif olarak incelenmiştir. Bu parametreler tedavi grupları arasında 0. ve 10. günlere göre karşılaştırılmıştır. Ayrıca her iki grupta 0. ila 10. gün arasındaki tedaviye bağlı değişimler de incelenmiştir.
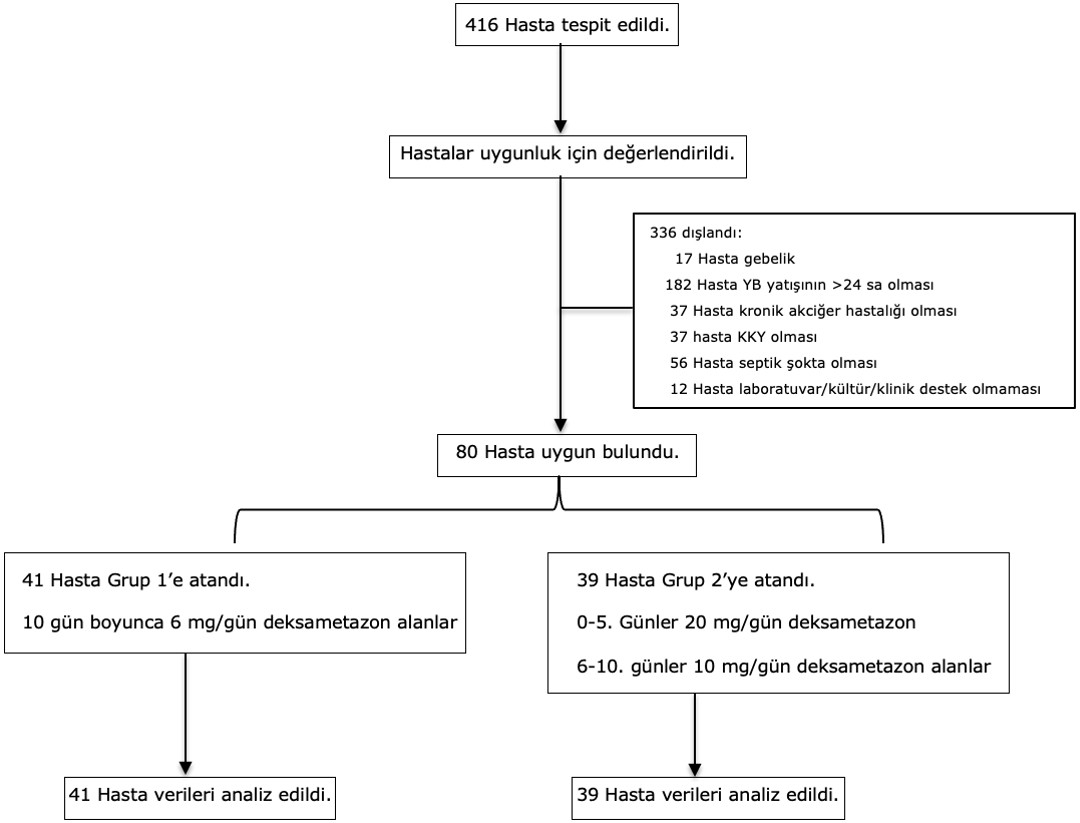
Çalışmaya dahil edilme kriterleri; ≥18 yaş olmak, Anesteziyoloji ve Reanimasyon Pandemi Yoğun Bakım Ünitesi’nde COVID-19 tanısı ile takip edilip deksametazon tedavisi almış ARDS hastası olmak. Çalışmadan dışlama kriterleri; <18 yaş olmak, gebelik, emzirme, yoğun bakım yatışının <24 saat olması, deksametazon kullanımının kontraendike olduğu durumlar, daha öncesinde deksametazon kullanımı, konjestif kalp yetmezliği, kronik akciğer hastalığı, septik şok ve laboratuvar, kültür ve klinik destekli enfeksiyon durumudur.
ARDS tanısı Berlin Kriterleri’ne göre hem klinik hem de radyolojik parametreler ile yapılmıştır. Son bir hafta içinde ani olarak gelişen dispne ve takipne ile birlikte, akciğer grafisinde bilateral yaygın infiltrasyon ve solunum yetmezliği tablosunun kalp yetmezliği ile açıklanamaması ARDS olarak değerlendirilmiştir.
İstatistiksel analiz için SPSS 18.0 programı kullanılmıştır. Tanımlayıcı istatistikler; kategorik değişkenler için sayı ve yüzde, sayısal değişkenler için ortalama ve standart sapma olarak verilmiştir. Gruplar karşılaştırılırken kategorik değişkenler için Ki-kare ve Fisher Exact testi kullanılmıştır. Sayısal değişkenlerin iki grup karşılaştırmaları Student-t testi ile yapılmıştır. Değerlendirilmede anlamlılık düzeyi olarak p<0.05 kabul edilmiştir.
Tüm yazarlar çalışmayı tasarlamış, verileri toplamış ve analizini gerçekleştirmiştir. Ayrıca makaleyi gözden geçirmiş, doğruluğuna ve verilerin eksiksizliğine tanıklık etmiş ve makalenin yayına sunulması kararını onaylamıştır.
Hangi hastaya hangi doz kortikosteroid verileceğine, hastaların yoğun bakımda primer tedavisini üstlenen uzman hekimler tarafından, hasta kliniğine göre güncel kılavuzlar ve yayınlar doğrultusunda karar verilmiştir.
Bulgular
Bu araştırma; 1 Ağustos 2020 ile 1 Mart 2021 tarihleri arasında Anesteziyoloji ve Reanimasyon Pandemi Yoğun Bakım Üniteleri’nde tedavi alan hastalar ile yapılmıştır. Hastalar aşağıdaki akış şemasında özetlenmiştir (Şekil 1).
Çalışma % 45’i kadın (n=36), % 55’i erkek (n=44) toplam 80 hasta ile yapılmıştır. Grup 1 (6 mg deksametazon uygulanan) 41 hasta, grup 2 (20 mg deksametazon uygulanan) 39 hasta içermektedir. Hastaların yaşları 23 ile 95 arasında değişmekte olup; 6 mg grubunda 74.20±9.955 yaş, 20 mg grubunda 69.56±14.456 yaş olarak saptanmıştır.
Tablo 1’de hastaların demografik verileri gösterilmiş ve APACHE II skoru, geliş PCR durumu, entübasyon günü, yoğun bakım kalış günü, hastane kalış günü ve yoğun bakım ölüm günü karşılaştırılmıştır.
|
Ort: Ortalama, SS: Standart Sapma a: Student’s t-test, b: Chi-Square Test; *: p < 0.05 |
|||
| Tablo 1. Demografik özellikler ile Klinik Değerlendirmeler (APACHE II skoru, geliş PCR durumu, entübasyon günü, yoğun bakım kalış günü, hastane kalış günü ve yoğun bakım ölüm günü) | |||
| 6 mg Deksametazon Grubu (n:41) | 20 mg Deksametazon Grubu (n:39) | p | |
| Yaş (Yıl) (Ort±SS) | 74,2±9,955 | 69,56±14,456 | a0,098 |
| Cinsiyet | |||
| Kadın n (%) | 23 (56,1) | 13 (33,3) | b0,041* |
| Erkek n (%) | 18 (43,9) | 26 (66,7) | |
| APACHE II Skoru (Ort±SS) | 16,59±6,659 | 20,69±10,319 | a0,039* |
| Kabul PCR Durumu | b0,114 | ||
| Negatif n (%) | 18 (43,9) | 24 (61,5) | |
| Pozitif n (%) | 23 (56,1) | 15 (38,5) | |
| Entübasyon Günü (Ort±SS) | 3,71±4,026 | 3,85±5,251 | a0,912 |
| Yoğun Bakım Kalış Süresi (Ort±SS) | 11,68 ± 6,385 | 9,54±6,668 | a0,146 |
| Yoğun Bakımda Ölüm Günü (Ort±SS) | 12,13±7,088 | 9,14±6,278 | a0,088 |
| Hastanede Kalış Süresi (Ort±SS) | 14,54± 7,57 | 11,95±7,138 | a0,120 |
Uygulanan her iki doz arasında yaş, entübasyon günü, yoğun bakım kalış süresi, hastanede kalış süresi ve yoğun bakımdaki ölüm günleri arasında istatistiksel olarak anlamlı bir fark saptanmamıştır. APACHE II skorları 20 mg deksametazon tedavisi verilen hastalarda, 6 mg deksametazon tedavisi alanlara göre daha yüksek tespit edilmiştir ve istatistiksel olarak anlamlı bulunmuştur (p:0,039).
Tablo 2’de hastaların gruplara göre komorbid hastalıkları karşılaştırılmıştır. Karşılaştırmada istatistiksel anlamlı farklılık tespit edilmemiştir.
|
HT: Hipertansiyon, DM: Diabetes Mellitus, KAH: Koroner Arter Hastalığı, KY: Kalp Yetmezliği, Kr. AF: Kronik Atriyal Fibrilasyon; Diğer: Kronik böbrek yetmezliği, Serebrovasküler hastalık, Akciğer kanseri, Meme kanseri, Hipotiroidi, Siroz, Renal transplantasyon, Parkinson, Malign melanom, Kronik anemi, Glioblastome multiforme, Çölyak hastalığı Chi-Square Test; *: p < 0.05 |
|||
| Tablo 2. Komorbid hastalıklar | |||
| 6 mg Deksametazon Grubu (n:41) | 20 mg Deksametazon Grubu (n:39) | p | |
| Komorbidite Var n (%) | 33 (80,5) | 36 (92,3) | 0,125 |
| HT n (%) | 19 (46,3) | 21 (53,8) | 0,502 |
| DM n (%) | 10 (24,4) | 14 (35,9) | 0,262 |
| KAH n (%) | 9 (22) | 8 (20,5) | 0,875 |
| KY n (%) | 5 (12,2) | 4 (10,3) | 0,784 |
| Kr. AF n (%) | 3 (7,3) | 2 (5,1) | 0,686 |
| KOAH n (%) | 6 (14,6) | 4 (10,3) | 0,554 |
| Alzheimer n (%) | 4 (9,8) | 3 (7,7) | 0,744 |
| Diğer n (%) | 13 (31,7) | 18 (46,2) | 0,185 |
Hastaların yoğun bakıma kabulündeki ve 10 günlük deksametazon tedavisi sonrasındaki 10. gün hemogram parametreleri incelenmiştir. Tablo 3’te 6 mg grubunun, Tablo 4’te 20 mg grubunun sonuçları özetlenmiştir. 6 mg grubunda NEU, NEU(%), LYM(%), RDW-CV ve PDW değerleri 0. gün ve 10. gün arasında istatistiksel olarak anlamlı bulunmuştur (p:0.022, p:0.004, p:0.01, p:0.001, p:0.001). 20 mg grubunda ise NEU/LYM, MPV ve PDW değerleri istatistiksel olarak anlamlı bulunmuştur (p:0.044, p:0.001, p:0.001).
|
Ort: Ortalama, SS: Standart Sapma NEU/LYM: Nötrofil/ Lenfosit değeri, NEU%/LYM: Nötrofil yüzdesi/Lenfosit değeri, PLT/LYM: Trombosit/Lenfosit değeri, RDW-CV: Eritrosit dağılım genişliği-Varyasyon katsayısı, MPV: Ortalama trombosit hacmi, PDW: Trombosit dağılım genişliği Student’s t-testi *: p<0.05 |
|||
| Tablo 3. 6 mg deksametazon grubunun hemogram parametrelerinin 0. ve 10. gün karşılaştırılması | |||
| 6 mg Deksametazon Grubu (n:41) | 0. gün | 10. gün | p |
| Beyaz Küre (10^3/uL) (Ort±SS) | 11741,94±4947,63 | 15345,48±8427,66 | 0,058 |
| Trombosit (10^3/uL) (Ort±SS) | 236354,84±83294,48 | 242161,29±132580,57 | 0,411 |
| Nötrofil (10^3/uL) (Ort±SS) | 10267,1±4642,35 | 13896,77±8221,36 | 0,022* |
| Nötrofil (%) (Ort±SS) | 86,28±10,98 | 87,48±10,36 | 0,004* |
| Lenfosit (10^3/uL) (Ort±SS) | 968,71±1339,83 | 800,9±472,98 | 0,119 |
| Lenfosit (%) (Ort±SS) | 9,09±9,37 | 8,15±7,98 | 0,010* |
| NEU/LYM (Ort±SS) | 20,88±20,18 | 24,84±23,08 | 0,079 |
| NEU%/LYM (Ort±SS) | 0,18±0,13 | 0,15±0,1 | 0,062 |
| PLT/LYM (Ort±SS) | 439,73±365,7 | 392,33±258,27 | 0,092 |
| RDW-CV (%) (Ort±SS) | 14,88±2,01 | 15,38±2,07 | 0,001* |
| MPV (fL) (Ort±SS) | 10,92±5,66 | 10,37±1,57 | 0,106 |
| PDW (%) (Ort±SS) | 16,21±0,42 | 16,37±0,58 | 0,001* |
|
Ort: Ortalama, SS: Standart Sapma NEU/LYM: Nötrofil/ Lenfosit değeri, NEU%/LYM: Nötrofil yüzdesi/Lenfosit değeri, PLT/LYM: Trombosit / Lenfosit değeri, RDW-CV: Eritrosit dağılım genişliği-Varyasyon katsayısı, MPV: Ortalama trombosit hacmi, PDW: Trombosit dağılım genişliği Student’s t-testi *: p<0.05 |
|||
| Tablo 4. 20 mg deksametazon grubunun hemogram parametrelerinin 0. ve 10. gün karşılaştırılması | |||
| 20 mg Deksametazon Grubu (n:39) | 0. gün | 10. gün | p |
| Beyaz Küre (103/uL) (Ort±SS) | 13743,29±7000,55 | 21688,57±24044,49 | 0,330 |
| Trombosit (103/uL) (Ort±SS) | 255523,81±137377,81 | 204571,43±134294,29 | 0,799 |
| Nötrofil (103/uL) (Ort±SS) | 12500±6586,78 | 16338,1±12952,04 | 0,070 |
| Nötrofil (%) (Ort±SS) | 88,62±11,35 | 85,12±9,49 | 0,084 |
| Lenfosit (103/uL) (Ort±SS) | 749,52±405,54 | 1064,29±705,18 | 0,296 |
| Lenfosit (%) (Ort±SS) | 7,99±10,67 | 7,7±5,27 | 0,593 |
| NEU/LYM (Ort±SS) | 19,53±11,28 | 23,62±29,04 | 0,044* |
| NEU%/LYM (Ort±SS) | 0,2±0,17 | 0,12±0,1 | 0,221 |
| PLT/LYM (Ort±SS) | 470,6±319,26 | 232,42±165,67 | 0,497 |
| RDW-CV (%) (Ort±SS) | 14,75±2,75 | 14,65±2,41 | 0,065 |
| MPV (fL) (Ort±SS) | 9,62±1,59 | 10,43±1,61 | 0,001* |
| PDW (%) (Ort±SS) | 16,18±0,46 | 16,55±0,61 | 0,001* |
Hastaların yoğun bakıma kabulündeki ve 10 günlük deksametazon tedavisi sonrasındaki 10. gün biyokimya parametreleri incelenmiştir. Tablo 5’te 6 mg grubunun, Tablo 6’da 20 mg grubunun sonuçları özetlenmiştir. 6 mg grubunda ferritin, CRP, albümin değerleri 0. gün ve 10. gün arasında istatistiksel olarak anlamlı bulunmuştur (p:0.002, p:0.045, p:0.007). 20 mg grubunda ise prokalsitonin, ferritin, albümin değerleri istatistiksel olarak anlamlı bulunmuştur (p:0.01, p:0.042, p:0.038).
|
Ort: Ortalama, SS: Standart Sapma Student’s t-testi *: p<0.05 |
|||
| Tablo 5. 6 mg deksametazon grubunun biyokimya parametrelerinin 0. ve 10. gün karşılaştırılması | |||
| 6 mg Deksametazon Grubu (n:41) | 0. gün | 10. gün | p |
| Prokalsitonin (ng/mL) (Ort±SS) | 2,05±4,99 | 4,56±12,47 | 0,063 |
| Ferritin (ug/L) (Ort±SS) | 416,13±373,28 | 476,71±422,42 | 0,002* |
| D-Dimer (ng/mL) (Ort±SS) | 1956,16±1404,9 | 2470,16±1676,06 | 0,445 |
| CRP (mg/L) (Ort±SS) | 130,7±93,65 | 114,5±109,5 | 0,045* |
| Albümin (g/L) (Ort±SS) | 29±4,2 | 25,87±3,77 | 0,007* |
|
Ort: Ortalama, SS: Standart Sapma Student’s t-testi *: p<0.05 |
|||
| Tablo 6. 20 mg deksametazon grubunun biyokimya parametrelerinin 0. ve 10. gün karşılaştırılması | |||
| 20 mg Deksametazon Grubu (n:39) | 0. gün | 10. gün | p |
| Prokalsitonin (ng/mL) (Ort±SS) | 13,17±25,56 | 4,48±11,89 | 0,010* |
| Ferritin (ug/L) (Ort±SS) | 537,33±519,3 | 551,81±528,53 | 0,042* |
| D-Dimer (ng/mL) (Ort±SS) | 2859,71±1464,48 | 2152,71±1214,11 | 0,195 |
| CRP (mg/L) (Ort±SS) | 129,88±79,9 | 82,27±52,94 | 0,256 |
| Albümin (g/L) (Ort±SS) | 29,24±4,07 | 25,05±4,78 | 0,038* |
Hastaların yoğun bakıma kabulündeki ve 10 günlük deksametazon tedavisi sonrasındaki 10. gün ventilasyon parametreleri incelenmiştir. Tablo 7’de 6 mg ve 20 mg grubunun sonuçları özetlenmiştir. Plato basıncı, peak basıncı ve kompliyans değerleri 0. gün ve 10. gün arasında istatistiksel olarak anlamlı bulunmuştur (p:0.001, p:0.001, p:0.001).
|
Ort: Ortalama, SS: Standart Sapma Peak Basıncı: Tepe basıncı Student’s t-testi *: p < 0.05 |
|||||||
| Tablo 7. 6 ve 20 mg deksametazon gruplarının ventilasyon parametrelerinin 0. ve 10. gün değerlerine göre karşılaştırılması | |||||||
| 6 mg grubu |
|
|
|
20 mg grubu |
|
|
|
| Plato Basıncı (cmH2O) Ort±SS |
|
|
|
Plato Basıncı (cmH2O) Ort±SS |
|
|
|
| Peak Basıncı (cmH2O) Ort±SS |
|
|
|
Peak Basıncı (cmH2O) Ort±SS |
|
|
|
| Kompliyans (ml/cmH2O) Ort±SS |
|
|
|
Kompliyans (ml/cmH2O) Ort±SS |
|
|
|
Hastaların yoğun bakımdaki deksametazon tedavisi sonrasında hemogram, biyokimya ve ventilasyon parametrelerindeki değişkenlerin; 0. günden 10. güne kadar olan değişimleri, bu değerler arasındaki fark Δ(10-0) olarak ifade edilmiştir. Bu parametre farkları her 2 grup için Tablo 8 ve Tablo 9’da ayrıntılı olarak incelenmiştir. Sadece prokalsitonin ve D-Dimer değerlerinde istatistiksel olarak anlamlı farklılık tespit edilmiştir (p:0.038 ve p:0.025). Diğer parametrelerde anlamlı bir fark görülmemiştir.
|
Δ: Değişkenlerin 0. ve 10. gün değerleri arasındaki fark (10. Gün-0. Gün) Ort: Ortalama, SS: Standart Sapma, NEU/LYM: Nötrofil/ Lenfosit değeri, NEU%/LYM: Nötrofil yüzdesi/Lenfosit değeri, PLT/LYM: Trombosit / Lenfosit değeri, RDW-CV: Eritrosit dağılım genişliği-Varyasyon katsayısı, MPV: Ortalama trombosit hacmi, PDW: Trombosit dağılım genişliği Student’s t-testi *: p<0.05 |
|||
| Tablo 8. Hemogram parametrelerinin her iki grupta 0-10. gün arasındaki tedaviye bağlı değişimlerinin karşılaştırılması | |||
| 6 mg Deksametazon, (n:41) | 20 mg Deksametazon, (n:39) | p | |
| ΔBeyaz Küre (103/uL) (Ort±SS) | 3603,55±8175,75 | 7945,29±23492,55 | 0,346 |
| ΔTrombosit (103/uL) (Ort±SS) | 5806,45±145389 | -50952,38±197700,65 | 0,238 |
| ΔNötrofil (103/uL) (Ort±SS) | 3629,68±7603,65 | 3838,1±11935,66 | 0,939 |
| ΔNötrofil (%) (Ort±SS) | 1,2±10,66 | -3,5±11,64 | 0,139 |
| ΔLenfosit (10^3/uL) (Ort±SS) | -167,81±1286,88 | 314,76±724,51 | 0,126 |
| ΔLenfosit (%) (Ort±SS) | -0,94±9,11 | -0,3±11,3 | 0,821 |
| ΔNEU/LYM (Ort±SS) | 3,96±25,34 | 4,09±26,09 | 0,985 |
| ΔNEU%/LYM (Ort±SS) | -0,02±0,14 | -0,07±0,17 | 0,237 |
| ΔPLT/LYM (Ort±SS) | -47,41±377,14 | -238,19±335,82 | 0,067 |
| ΔRDW-CV (%) (Ort±SS) | 0,5±0,73 | -0,1±2,82 | 0,348 |
| ΔMPV (fL) (Ort±SS) | -0,55±5,41 | 0,81±1,24 | 0,263 |
| ΔPDW (%) (Ort±SS) | 0,16±0,46 | 0,37±0,47 | 0,119 |
|
Δ: Değişkenlerin 0. ve 10. gün değerleri arasındaki fark ( 10. Gün-0. Gün ) Ort: Ortalama, SS: Standart Sapma Student’s t-testi *:p<0.05 |
|||
| Tablo 9. Biyokimya parametrelerinin her iki grupta 0-10. gün arasındaki tedaviye bağlı değişimlerinin karşılaştırılması | |||
| 6 mg Deksametazon, (n:41) | 20 mg Deksametazon, (n:39) | p | |
| ΔProkalsitonin (ng/mL) (Ort±SS) | 2,51±11,76 | -8,7±21,48 | 0,038* |
| ΔFerritin (ug/L) (Ort±SS) | 60,58±382,17 | 14,48±550,82 | 0,723 |
| ΔD-Dimer (ng/mL) (Ort±SS) | 514±2027,91 | -707±1603,58 | 0,025* |
| ΔCRP (mg/L) (Ort±SS) | -16,2±115,4 | -47,61±83,62 | 0,290 |
| ΔAlbümin (g/L) (Ort±SS) | -3,13±4,09 | -4,19±4,65 | 0,389 |
Çalışmamızın birincil sonlanım noktası olan 28 günlük mortalite oranları açısından hastalar, hem gruplara hem de çeşitli faktörlere göre incelenmiş ve elde edilen bulgular Tablo 10 ile Tablo 11’de özetlenmiştir. Bu faktörler hastaların aldıkları deksametazon tedavi dozu, komorbid hastalık varlığı, PCR durumu, geliş solunum paterni, toraks BT bulgusu, deksametazon tedavisinin 10. günündeki solunum paterni durumudur. Bunlardan sadece geliş solunum paterni, deksametazon tedavisinin 10.günündeki solunum paterni ve 10 günlük deksametazon tedavisi sonrasında solunum paterni değişimi istatistiksel olarak anlamlı bulunmuştur (p:0.013, p:0.001, p:0.001).
|
Chi-Square Test *: p<0.05 |
|||
| Tablo 10. 28 günlük yoğun bakım mortalitesine göre karşılaştırılması | |||
|
|
|
|
|
| 6 mg tedavi grubu n (%) |
|
|
|
| 20 mg tedavi grubu n (%) |
|
|
|
| Table 11. 28 günlük yoğun bakım mortalitesine etki eden faktörlerin karşılaştırılması | |||
|
|
|
|
|
| Ek hastalıklar n (%) | |||
| Yok |
|
|
|
| Var |
|
|
|
| HT |
|
|
|
| DM |
|
|
|
| KAH |
|
|
|
| KY |
|
|
|
| Kr. AF |
|
|
|
| KOAH |
|
|
|
| Astım |
|
|
|
| Alzheimer |
|
|
|
| Diğer |
|
|
|
| Toraks tomografi bulguları n (%) | |||
| Tutulum yok |
|
|
|
| Covid 19 uyumlu |
|
|
|
| Bileteral yaygın tutulum |
|
|
|
| Geliş solunum paterni n (%) | |||
| Spontan solunum |
|
|
|
| Entübe |
|
|
|
| 10.günündeki solunum paterni n (%) | |||
| Spontan solunum |
|
|
|
| Entübe |
|
|
|
|
Kr. AF: Kronik atriyal fibrilasyon Chi-Square Test ve FisherExact Test *: p<0.05 |
|||
Tartışma
Çalışmamızda deksametazon dozlarının 28 günlük mortaliteye etkisinin yanında; sıfır ile onuncu günlerindeki laboratuvar parametrelerine, ventilasyon parametrelerine ve klinik sonuçlara etkisini hiperinflamasyon penceresinden bakarak karşılaştırdık. Bunun sonucunda uygulanan deksametazon dozunun mortalite üzerine etkisi olmadığını, fakat inflamasyonu baskılamada ve mekanik ventilasyondaki akciğer mekanikleri üzerine 20 mg dozunun bazı olumlu farklar oluşturduğunu gözlemledik.
Literatürde SARS-CoV-2’ye bağlı olanlarla birlikte çeşitli nedenlerle ARDS gelişen hastalarda deksametazon kullanımını inceleyen çalışmalar mevcuttur. Bu çalışmalarda özellikle deksametazon tedavisinin mortalite ve ventilasyon ihtiyacına olan etkisi araştırılmıştır (1,2,9-11). Bu çalışmalar arasında önemli bir yeri olan Recovery çalışmasının yayınlanmasından bu yana oksijen tedavisine ihtiyaç duyan COVID-19 hastalarının tedavisinde kullanılmak üzere önerilen deksametazon dozu 6 mg şeklinde olmuştur (10). Ancak daha yüksek bir dozun COVID-19 hastalarında mortalite açısından daha etkili olabileceğini gösteren çalışmalar da yapılmıştır (11). Çalışmamızda kullanılan yüksek deksametazon dozu COVID-19 ve COVID-19 dışı ARDS hastalarında faydası gösterilen önceki çalışmalara dayanarak seçilmiştir (2,11,12).
Çalışmamızda uygulanan her iki doz arasında cinsiyet açısından istatistiksel olarak anlamlı bir fark saptanmıştır. Hastaların % 55’i erkek olarak tespit edilmiştir. Bu sonucun Abate’in(13) yaptığı meta-analiz çalışmasında da belirttiği gibi; erkek cinsiyetin hiperinflamasyon ve ARDS gelişiminde daha riskli bulunduğu sonucuna paralel olduğunu düşünmekteyiz.
Yoğun bakımda takip edilen hastaların prognozlarını ve mortalite risklerini değerlendirmede sıklıkla skorlama sistemleri kullanılmaktadır (14). Bu amaçla çalışmamıza dahil ettiğimiz APACHE II skorunun istatistik sonuçlarını incelediğimizde; 20 mg deksametazon verilmiş grupta daha yüksek olduğunu gördük. CAO’nun(15) 2021 yılında yaptığı çalışmasında; kritik COVID-19 hastalarında daha yüksek APACHE II skorlarının bulunmasının, popülasyondaki mortaliteyi öngördüğünü belirtmiştir. Çalışmamızda hangi hastaya hangi doz deksametazon verileceğine; hastalardan sorumlu primer hekimler; hastaların klinik durumları, güncel kılavuzlar ve yayınlara göre karar vermiştir. Elde ettiğimiz veriler doğrultusunda; hastaneye başvuruda genel durumu daha kötü olan, orta ve ağır şiddetteki hastalara daha yüksek doz (20 mg) kortikosteroid tedavisi başlandığını görmekteyiz. ARDS gibi yüksek mortalite oranının beklendiği hastalarda, APACHE II skorlarının da yüksek olması; orta ve ağır şiddetteki COVID-19 hastalarına 20 mg deksametazon tedavisinin daha fazla tercih edilmesini gösterilebilir. Bunun altında yatan düşüncenin hiperiflamasyonun 20 mg ile daha fazla baskılanma stratejisi olduğunu belirtebiliriz.
Literatürdeki pek çok çalışmada COVID-19 hastaları için komorbid hastalık varlığı yüksek risk faktörü olarak değerlendirilmiştir (1,7). Hastalarımızın komorbid hastalık varlıkları incelendiğinde her 2 grup arasında anlamlı bir fark bulunmamıştır. Bu sonuç her iki grubun yandaş hastalıklar açısından homojen dağıldığını göstermektedir. Bu da bize her iki deksametazon dozunu benzer yandaş hastalık zemininde benzer gruplarda karşılaştırma fırsatı sağlamıştır.
Çalışmamızda mortalite değerlendirilmesinin yanında; literatürde COVID-19 vakalarında henüz incelenmemiş olan iki farklı deksametazon dozunun etkilediği laboratuvar parametrelerinin inflamasyon penceresinden karşılaştırmasına yer verdik. Hastaların yoğun bakımdaki 10 günlük deksametazon tedavisi sonrasında ki hemogram parametrelerinde ki değişkenlerin her iki deksametazon dozu grubu içinde 0. günden 10. güne doğru değişimlerinin karşılaştırılmasında; 6 mg grubunda NEU, NEU %, RDW-CV ve PDW değerleri istatistiksel olarak anlamlı artış gösterirken, LYM % değeri sistemik inflamasyonun artmasını destekler şekilde düşüş göstermiştir. 20 mg grubunda ise NEU/LYM, MPV ve PDW değerleri yine sistemik inflamasyonun artmasını destekler şekilde istatistiksel olarak anlamlı artış göstermiştir. Literatürü incelediğimizde; COVID-19 hastalarında NEU, NEU %, RDW-CV, PDW, NEU/LYM, MPV, ferritin, CRP ve prokalsitonin parametrelerinin arttığını gösteren çalışmalar ile birlikte; uygulanan tedavi ile bahsi geçen inflamatuar parametrelerinin değişebileceğini gördük (1,7). Örneğin Azizmohammadi(16) yaptığı bir çalışmasında COVID-19 ile takip edilen hastalara uygulanan deksametazon ve antiviral tedavinin NEU ve NEU %’ini düşürdüğünü rapor etmiştir. Son zamanlarda yine RDW-CV’nin sistemik inflamasyon ile ilerleyen sepsis veya ARDS gibi hastalıkların mortalite değerlendirmesinde yararlı bir gösterge olabileceğini bildiren yayınlar mevcuttur (17). Zinellu ve ark.(18) yaptıkları bir meta-analiz çalışmasında, yüksek RDW-CV değerlerinin COVID-19 şiddeti ve mortalitesi ile önemli ölçüde ilişkili olduğunu göstermişlerdir. Kan sayımlarında rutin bakılan bir başka parametre olan MPV değeri ile mortalite arasında Güçlü ve arkadaşlarının COVID-19 hastalarında yaptıkları bir çalışmada da anlamlı bir ilişki tespit edilmiştir. Aynı çalışmada PDW’nin sepsis gibi COVID-19 hastalarında da yüksek seviyelerde bulunduğu gösterilmiştir (19,20). Çalışmamızda karşılaştığımız sonuçlarla hem 6 mg hem de 20 mg gruplarında, 10 günlük tedavi sonunda hiperinflamasyonun tamamen baskılanamadığını; ARDS tablosunun ilerleyip hastaların entübe olmasını takiben, kontrolsüz inflamasyonun mortaliteye yadsınamaz katkısını fark ettik. Bununla birlikte ve bunu destekler şekilde 0. gündeki hiperinflamasyon sebepli ARDS ile entübe edilen ve invaziv mekanik ventilasyon tedavisi alan hastalarda, entübe olmayan hastalara göre anlamlı bir mortalite artışı gözlemledik. Sistemik hiperinflamasyonun baskılanmasında deksametazon tedavisinin yanında diğer immünsupresif medikasyonların gerekliliğinin, tedavi seyrinde günlük olarak değerlendirilmesi gerektiği tekrar gün yüzüne çıkmaktadır. Hastaların yoğun bakımdaki 10 günlük deksametazon tedavisi sonrasında biyokimya parametrelerindeki değişkenlerin her iki deksametazon dozu grubu içinde 0. günden 10. güne doğru değişimlerinin karşılaştırılmasında; inflamasyonun artışını destekler şekilde 6 mg grubunda ferritin değerleri istatistiksel olarak anlamlı artış ve albumin değerleri düşüş gösterirken; inflamasyonun azalmasını gösteren CRP değerlerinde düşüş gözlenmiştir. Ayrıca 10 günlük tedaviye cevap olarak 20 mg grubunda antihiperinflamasyon lehine prokalsitonin değerlerinde anlamlı bir düşme olduğu ancak ferritin yüksekliği ve albumin düşüklüğü farkedilmiştir. Bu da inflamasyon artışını desteklemektedir. Literatüre baktığımızda prokalsitonin, ferritin, CRP ve D-Dimer gibi biyokimyasal parametrelerin seviyelerinin COVID-19 hastalarında özellikle ciddi hastalık durumunda yükseldiği gösterilmiştir (21). 2023 yılında Hong ve ark.(22) yaptıkları bir meta-analiz çalışmasında, glukokortikoid tedavisinin şiddetli COVID-19 hastalarındaki sistemik inflamatuar yanıta etkisini araştırmışlardır. Çalışma sonucunda metilprednizolonun hiperinflamasyonu deksametazondan daha iyi baskıladığını ifade etmişlerdir. Bu çalışmada ele aldıkları inflamatuar belirteçler ise CRP ve ferritindir. Literatürü incelemeye devam ettiğimizde deksametazonun COVID-19 tedavisindeki dozunun, ferritin ve CRP düzeylerine olan etkisiyle ilgili yapılmış bir çalışmaya rastlamadık.
Çalışmamız sonucunda hem 6 mg hem de 20 mg deksametazon dozu grupları, kendi içlerinde 0. ve 10. gün hemogram ve biyokimya parametrelerinde inflamasyonu baskılayamadıkları ortaya çıkmıştır. Antihiperinfamatuar etkinlik 6 mg grubunda sadece CRP düşüşünde; 20 mg grubunda ise prokalsitonin düşüşünde kendini göstermiştir. Bu yüzden deksametazonun iki dozunun da tam olarak inflamasyonu baskılayamadığını düşünmekteyiz.
Çalışmamızın bu noktasında ventilasyon parametrelerine baktığımızda, hemogram ve biyokimyasal parametrelerin antihiperinflamatuar etkinlik başarısızlığına zıt olarak şaşırtıcı bir sonuç karşımıza çıkmaktadır. 20 mg grubunda 0. günden 10. güne doğru plato basıncı ve tepe basıncının azaldığını, kompliyansın ise arttığını belirledik. Böyle bir etkiye 6 mg grubunda rastlamadık. Fakat bu parametre değişimlerinin sağlıklı bir karşılaştırma yapma noktasındaki sınırlayıcı bir durumu da; takip sırasında entübe hasta sayılarındaki değişimin bir kısmının hasta kayıplarından kaynaklanmasıdır. Özellikle, 20 mg grubunda 10. gündeki entübe hasta sayısının düşüşü, bazı hastaların kaybedilmesi sonucu gerçekleşmiştir. Bu nedenle bu sonucun gruplar arasında tedavi etkinliğini karşılaştırmada dikkate alınması gerektiğinin altını çizmek isteriz. Literatürde benzer şekilde sonuçları olan Villar’ın(4) yapmış olduğu bir çalışma mevcuttur. Bu çalışmada entübe olan multifaktöriyel kökenli ARDS hastalarına 20 mg deksametazon verilmiş ve ventilatöre bağlı gün sayısının daha az olduğu bulunmuştur. Keskinidou ve ark.(23) yaptığı başka bir çalışmada ise 6 mg deksametazonun özellikle entübe olan ve tedaviye ilk 1 hafta içinde başlananlarda daha faydalı olduğu bulunmuştur. Bu sonuç inflamasyonun başlamasını önlemek için ideal olarak kortikosteroidlerin inflamasyonun erken evrelerinde başlanması gerektiğine inanmamıza yol açmıştır. 20 mg veya 6 mg dozlarının hangisinin seçilmesi gerektiği ise henüz çok net değildir.
Çalışmamızın bir diğer başlığı olan gruplar arası laboratuvar parametrelerinin 0. günden 10. güne doğru değişimlerini (Δ) incelediğimizde ise ventilasyon parametrelerindeki iyileşmeyi destekleyen bazı verilere rastladık. 10 günlük deksamezaton tedavisi sonrası biyokimya parametrelerinde iki grup arasında prokalsitonin ve D-Dimer değerlerinde istatistiksel olarak anlamlı farklılık tespit ettik. Her 2 parametrede 6 mg grubunda artma eğilimindeyken; 20 mg grubunda düşme göstermiştir. Yani 20 mg grubunda prokalsitonin ve D-Dimer düzeylerinin 10 günlük tedavi ile baskılanmış olduğunu bulduk. Bulgularımızı literatür ile karşılaştırdığımızda; Taboada ve ark.(10) yaptığı bir çalışmaya rastladık. Hastanede yatan 200 COVID-19 hastasında deksametazon dozlarını karşılaştırdıklarını ve 20 mg dozunun klinik kötüleşmeyi daha iyi baskıladığını belirtmiş olduklarını öğrendik. Gabarre ve ark.(24) başka bir çalışmada kritik hastalığı olan COVID-19 hastalarında deksametazon kullanımının hem proinflamatuar hem de prokoagülan aktivitede azalmayı sağladığını göstermişlerdir. Bizler çalışmamızda bulduğumuz sonuçlar ile bu durumu antihiperinflamasyona ve bunun sonucunda prokoagulan aktivitede azalmaya bağlamaktayız. Ayrıca COVID-19 veya başka nedenli hiperinflamatuar kliniklerde, D-Dimer ve prokalsitonin düzeyi azalması ile ventilasyon parametreleri iyileşmesi arasındaki ilişkinin irdelenmesinin gelecekte bize önemli bilgiler kazandıracağını düşünmekteyiz.
Çalışmamızın birincil sonlanım noktasına geldiğimizde 28 günlük mortalite açısından 6 mg ve 20 mg deksametazon tedavisi verilen grupları karşılaştırdık. İstatistiksel olarak anlamlı bir fark bulamadık. Literatürde COVID-19 hastalarında yapılan en geniş kapsamlı Recovery çalışmasında, 6 mg uygulanan hastalarda 28 günlük mortalitenin düştüğü belirtilmiştir (2). Villar(11) ise 20 mg deksametazon tedavisi uyguladığı çok merkezli ARDS çalışmasında genel mortalitenin azaldığını tespit etmiştir. Literatürde deksametazonun SARS-CoV-2’ye bağlı gelişen ARDS mortalitesini azalttığını gösteren ve yukarıda bahsi geçen birçok yayın(1,2,9-11) olmakla birlikte; doz konusunda inflamasyon açısından bir karşılaştırma olmadığını gördük. Çalışmamızın her iki grupta görülen yüksek mortalite sonuçlarına ilişkin; pandeminin çok erken safhasında henüz aşısız bireylerdeki kontrolsüz hiperinflamasyonun ve yoğun bakıma geç başvurunun etkili olduğunu düşünmekteyiz. Bu nedenle deksametazon kullanırken inflamatuar belirteçlerin seyrinin yakından ve monitörize şekilde takip edilmesinin önemli olduğunu düşünmekteyiz.
Mevcut bilgimize göre; yoğun bakımda takip edilen COVID-19 ARDS hastalarında deksametazon dozunun etkisini; hem klinik hem laboratuvar parametreler açısından değerlendiren, sistemik inflamasyon belirteçlerinin tedavi öncesi ve sonrası karşılaştırıldığı bir çalışma bulunmamaktadır. Çalışmamız bu anlamda bir ilk olma özelliği taşımaktadır.
Sonuç olarak; yoğun bakım ünitelerinde COVID-19 tanısı ile takip edilen ARDS hastalarında 20 mg deksametazon tedavisinin ventilasyon ve laboratuvar parametreleri biraz daha iyileştirdiği fakat mortaliteyi değiştirmediğini gözlemledik. Fayda/zarar oranı açısından bakıldığında; eğer hastamızın klinik durumunda hiperinflamasyon ön planda ise 20 mg dozu tercih edilebileceğini ancak hiperinflamasyonun ön planda olmadığı oksijen tedavisi ihtiyacı olan hastalarda ise 6 mg deksametazon dozunun tercih edilebileceğini öneriyoruz. Klinik durum değerlendirmesi yanında, Wang ve ark. (25) yaptıkları bir çalışmada belirttikleri gibi, bu tercihe yardımcı olabilecek İnterlökin 6 (IL-6) düzeyinin çalışılması da düşünülebilir. Ayrıca kortikosteroidlerin yan etki potensi dikkate alındığında inflamasyonu kontrol altına almak amacıyla 6 mg deksametazon tedavisinin 20 mg deksametazon tedavisine tercih edilebileceğini de unutmamak gerekir. COVID-19 tedavisinde sistemik kortikosteroidlerin etkinliğini ve güvenliğini değerlendiren, 11 randomize kontrollü çalışmayı içeren bir derlemede; sistemik kortikosteroidlerin muhtemelen COVID-19’lu hastaneye yatırılmış kişilerde tüm nedenlere bağlı ölümleri hafifçe azalttığı belirtilmiştir. Aynı derlemede kortikosteroidlerin farklı dozajlarını veya zamanlamasını değerlendiren yayınlanmış bir çalışmaya rastlanmadığı ifade edilmiştir (26). Bununla beraber COVID-19 tedavisinde kullanılacak kortikosteroid türü, dozu, kullanım zamanı ve tedavi süresince takip edilecek parametreler için daha büyük, randomize, kontrollü, prospektif ve çok merkezli çalışmalara ihtiyaç duyulduğunu düşünmekteyiz.
Sonuç
Günümüz pandemiler çağında kortikosteroidler, sadece COVID-19 için değil; başka hiperinflamatuar viral hastalıkların tedavisinde de kullanılacaktır. Bundan dolayı hiperinflamasyonun eşlik ettiği diğer viral solunum yolu enfeksiyonlarında oksijen tedavisi ihtiyacı olan olgularda 6 mg deksametazon dozunun, hiperinflamasyonun ön planda olduğu şiddetli olgularda ise 20 mg dozunun güvenle kullanılabileceğini öngörmekteyiz.
Kısıtlılıklar
Çalışmamız retrospektif olarak gerçekleştirilmiştir. Hasta sayısının düşük olmasını, tek merkezde yapılmış olmasını ve deksametazonun yan etkilerinin incelenmemesini çalışmamızın kısıtlıkları olarak görmekteyiz. Ayrıca çalışmamız 01.08.2020’den 01.03.2021 tarihine kadar sürmüştür. Yani şiddetli COVID-19 hastalarının tedavisinin, özellikle eş zamanlı tedaviler ve destekleyici bakım açısından büyük ölçüde değiştiği ve aşılamanın henüz başlamadığı bir zaman dilimini kapsadığını belirtmek isteriz.
Etik kurul onayı
Bu çalışma Kütahya Sağlık Bilimleri Üniversitesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu tarafından onaylanmıştır (onay tarihi: 17.03.2021, numarası: 2021/05-04). Çalışmaya katılan tüm katılımcılardan yazılı bilgilendirilmiş onam alınmıştır.
Yazarlık katkısı
Çalışma konsepti ve tasarımı: MY, MET, CB; veri toplama: MY; sonuçların analizi ve yorumlanması: MY, MET, CB; makaleyi hazırlama: MY, MET. Yazar(lar) sonuçları gözden geçirmiş ve makalenin son halini onaylamıştır.
Finansman
Yazar(lar), çalışmanın herhangi bir finansal destek almadığını beyan etmiştir.
Çıkar çatışması
Yazar(lar) herhangi bir çıkar çatışması olmadığını beyan etmiştir.
Referanslar
- Aydın NN, Aydın M, İba Yılmaz S. Evaluation of Hematological, Inflammatory and Coagulation Biomarkers as an Indicator of COVID-19 Severity. Flora the Journal of Infectious Diseases and Clinical Microbiology. 2023;28:188-97. https://doi.org/10.5578/flora.20239918
- The Recovery Collaborative Group; Horby P, Lim WS, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021;384:693-704. https://doi.org/10.1056/NEJMoa2021436
- Ak G, Yılmaz Ü. Covid-19 Pandemisinden Öğrendiklerimiz, Gelecek Öngörüleri ve Yarının Planlanması. İstanbul: Türkiye Solunum Araştırmaları Derneği; 2020.
- Villar J, Añón JM, Ferrando C, et al. Efficacy of dexamethasone treatment for patients with the acute respiratory distress syndrome caused by COVID-19: study protocol for a randomized controlled superiority trial. Trials. 2020;21:717. https://doi.org/10.1186/s13063-020-04643-1
- Zafer MM, El-Mahallawy HA, Ashour HM. Severe COVID-19 and Sepsis: Immune Pathogenesis and Laboratory Markers. Microorganisms. 2021;9:159. https://doi.org/10.3390/microorganisms9010159
- Ye Q, Wang B, Mao J. The pathogenesis and treatment of the 'Cytokine Storm' in COVID-19. J Infect. 2020;80:607-13. https://doi.org/10.1016/j.jinf.2020.03.037
- Henry BM, de Oliveira MHS, Benoit S, Plebani M, Lippi G. Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID-19): a meta-analysis. Clin Chem Lab Med. 2020;58:1021-8. https://doi.org/10.1515/cclm-2020-0369
- Stasi C, Fallani S, Voller F, Silvestri C. Treatment for COVID-19: An overview. Eur J Pharmacol. 2020;889:173644. https://doi.org/10.1016/j.ejphar.2020.173644
- Bouadma L, Mekontso-Dessap A, Burdet C, et al. High-Dose Dexamethasone and Oxygen Support Strategies in Intensive Care Unit Patients with Severe COVID-19 Acute Hypoxemic Respiratory Failure: The COVIDICUS Randomized Clinical Trial. JAMA Intern Med. 2022;182:906-16. https://doi.org/10.1001/jamainternmed.2022.2168
- Taboada M, Rodríguez N, Varela PM, et al. Effect of high versus low dose of dexamethasone on clinical worsening in patients hospitalised with moderate or severe COVID-19 pneumonia: an open-label, randomised clinical trial. Eur Respir J. 2022;60:2102518. https://doi.org/10.1183/13993003.02518-2021
- Villar J, Ferrando C, Martínez D, et al. Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled trial. Lancet Respir Med. 2020;8:267-76. https://doi.org/10.1016/S2213-2600(19)30417-5
- Abani O, Abbas A, Abbas F, et al.; RECOVERY Collaborative Group. Higher dose corticosteroids in patients admitted to hospital with COVID-19 who are hypoxic but not requiring ventilatory support (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2023;401:1499-507. https://doi.org/10.1016/S0140-6736(23)00510-X
- Abate BB, Kassie AM, Kassaw MW, Aragie TG, Masresha SA. Sex difference in coronavirus disease (COVID-19): a systematic review and meta-analysis. BMJ Open. 2020;10:e040129. https://doi.org/10.1136/bmjopen-2020-040129
- Karabıyık L. Yoğun bakımda skorlama sistemleri. Yoğun Bakım Dergisi. 2010;9(3):129-143.https://turkmedline.net/detay/yogun-bakimda-skorlama-sistemleri/ce125103272737ff/tr/66
- Cao L, Cherukuri K, Vu T, et al. APACHE II Score and Mortality Risk Prediction in a Californian Cohort of Critically Ill Patients With COVID-19. Chest 2021;160:A1032. https://doi.org/10.1016/j.chest.2021.07.957
- Azizmohammadi S, Azizmohammadi S, Dahmardeh S, et al. Analysis of 239 ordinary and severe cases of COVID-19: Clinical features and treatment. Eur J Transl Myol. 2021;31:9579. https://doi.org/10.4081/ejtm.2021.9579
- Moreno-Torres V, Sánchez-Chica E, Castejón R, et al. Red blood cell distribution width as a marker of hyperinflammation and mortality in COVID-19. Ann Palliat Med. 2022;11:2609-21. https://doi.org/10.21037/apm-22-119
- Zinellu A, Mangoni AA. Red blood cell distribution width, disease severity, and mortality in hospitalized patients with SARS-CoV-2 infection: A systematic review and meta-analysis. J Clin Med. 2021;10:286. https://doi.org/10.3390/jcm10020286
- Güçlü E, Kocayiğit H, Okan HD, et al. Effect of COVID-19 on platelet count and its indices. Rev Assoc Med Bras (1992). 2020;66:1122-7. https://doi.org/10.1590/1806-9282.66.8.1122
- Şenyurt O, Kaygusuz K, Avcı O, İsbir AC, Özdemir Kol İ, Gürsoy S. The relation of hemogram parameters with mortality in intensive care patients. Journal of CardioVascular Thoracic Anaesthesia and Intensive Care Society. 2018;24:165-71. https://doi.org/10.5222/GKDAD.2018.99267
- Ciaccio M, Agnello L. Biochemical biomarkers alterations in Coronavirus Disease 2019 (COVID-19). Diagnosis (Berl). 2020;7:365-72. https://doi.org/10.1515/dx-2020-0057
- Hong S, Wang H, Li S, Liu J, Qiao L. A systematic review and meta-analysis of glucocorticoids treatment in severe COVID-19: methylprednisolone versus dexamethasone. BMC Infect Dis. 2023;23:290. https://doi.org/10.1186/s12879-023-08280-2
- Keskinidou C, Vassiliou AG, Zacharis A, et al. Endothelial, Immunothrombotic, and Inflammatory Biomarkers in the Risk of Mortality in Critically Ill COVID-19 Patients: The Role of Dexamethasone. Diagnostics (Basel). 2021;11:1249. https://doi.org/10.3390/diagnostics11071249
- Gabarre P, Urbina T, Cunat S, et al. Impact of corticosteroids on the procoagulant profile of critically ill COVID-19 patients: a before-after study. Minerva Anestesiol. 2023;89:48-55. https://doi.org/10.23736/S0375-9393.22.16640-X
- Wang X, Tang G, Liu Y, et al. The role of IL-6 in coronavirus, especially in COVID-19. Front Pharmacol. 2022;13:1033674. https://doi.org/10.3389/fphar.2022.1033674
- Wagner C, Griesel M, Mikolajewska A, et al. Systemic corticosteroids for the treatment of COVID-19: Equity-related analyses and update on evidence. Cochrane Database Syst Rev. 2022;11:CD014963. https://doi.org/10.1002/14651858.cd014963.pub2
Telif hakkı ve lisans
Telif hakkı © 2025 Yazar(lar). Açık erişimli bu makale, orijinal çalışmaya uygun şekilde atıfta bulunulması koşuluyla, herhangi bir ortamda veya formatta sınırsız kullanım, dağıtım ve çoğaltmaya izin veren Creative Commons Attribution License (CC BY) altında dağıtılmıştır.